Dr. Chris Exley, Peligros del Aluminio en las Vacunas
Algunos médicos mediáticos repiten lo que dicen los CDC (Centros para el Control de Enfermedades) cuando afirman que las vacunas y los ingredientes de la vacunas han sido refutados como posibles causas del autismo. Las declaraciones de los CDC son genéricas y abarcan todas las vacunas y los ingredientes de la vacuna. Por ejemplo, el CDC indica: “Las vacunas no causan autismo”. “No hay relación entre las vacunas y el autismo.” “No se ha probado relación entre los ingredientes de las vacunas y el trastorno del espectro autista.” (Sitio web de CDC, agosto de 2017)
Estas declaraciones no son fundamentadas por la ciencia . Los CDC apoyan estas afirmaciones limitándose a la vacuna triple vírica, SRP (Taylor 2014), al conservante timerosal (Taylor 2014), y a la exposición al antígeno de la vacuna (DeStefano 2013).
El Dr. Frank DeStefano de la Oficina de Seguridad de Inmunización de los CDC es coautor de un artículo (Glanz 2015) que establece:
“Hasta la fecha, no se han realizado estudios de base poblacional específicamente diseñados para evaluar las asociaciones entre resultados clínicamente significativos y los ingredientes no-antígeno, aparte del timerosal.”
Esta afirmación se aplica, entre otros ingredientes de las vacunas, al adyuvante aluminio. Los estudios de la vacuna SRP (triple vírica, Sarampión, Rubeola, Paperas), (en inglés MMR), no pueden ser utilizados como evidencia de la seguridad de otras vacunas, por ejemplo, otras vacunas que contienen aluminio como adyuvante. Estas afirmaciones genéricas de que no hay vacunas ni ingredientes que causen autismo, no están fundamentadas por evidencias científicas. De hecho, las declaraciones de los CDC se contradicen con una vasta evidencia científica que incluye:
- Estudios que muestran efectos neurotóxicos y neuroinflamatorios (por ejemplo, la activación microglial) de dosis de adyuvantes de aluminio más bajas o similares a las dosis recibidas por los niños de acuerdo con el calendario de vacunación del CDC (Crepeaux 2017, Petrik 2007, Shaw 2013, Shaw 2009);
- Estudios que relacionan vacunas con lesiones cerebrales por la activación inmune (Zerbo 2016, Li 2015);
- Estudios que demuestran que la activación inmune en los primeros años de vida es un factor causal en el autismo y otros trastornos del desarrollo neurológico y enfermedades mentales (por ejemplo, esquizofrenia) (Meyer 2009, Deverman 2009, Estes 2016, Kneusel 2014, Careaga 2017, Meyer 2014).
Caso de autismo de Hanna Poling fué demostrado en la corte dado que el padre , médico y profesor de Harvard tenia estudios de su hija previos a la vacunación … Gracias a su influencia y acceso a laboratorios de alta complejidad no pudieron descartar el caso.
La evidencia indica que la vacuna induce la activación inmune, en particular los adyuvantes de aluminio que puede causar enfermedades mentales y trastornos del desarrollo neurológico, incluyendo autismo.
En este trabajo presentamos evidencia científica de que los adyuvantes de aluminio pueden causar autismo y otras lesiones cerebrales. Además, explicamos por qué los estudios de la presunta seguridad de los adyuvantes de aluminio no demuestran seguridad en resultados neurológicos adversos.
La activación inmune: causa de autismo y trastornos mentales
El término “activación inmune”, describe la activación de los componentes celulares del sistema inmune. El cerebro en desarrollo puede ser dañado por la activación inmune con consecuencias para toda la vida (Meyer 2009, Deverman 2009, Estes 2016, Kneusel 2014, Careaga 2017, Meyer 2014). La lesión por la activación inmune está vinculada con el autismo, la esquizofrenia, la depresión y otras enfermedades mentales o trastornos del neurodesarrollo. Los efectos de la activación inmune en el cerebro están mediados por el sistema inmunológico, especialmente por las citocinas (Estes 2016, Meyer 2014, Smith 2007, Choi 2016, de Pineda, 2013).
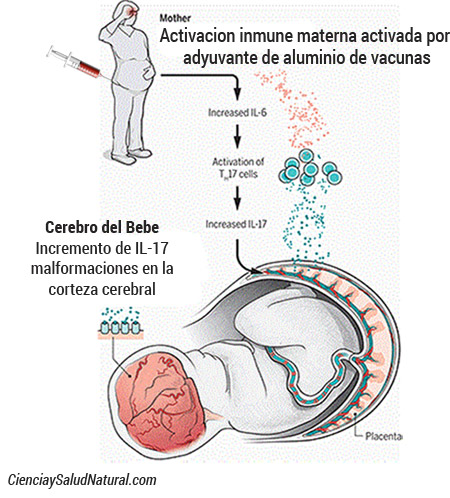
En general, se acepta que la activación inmune (por ejemplo, por una infección) durante el embarazo es un factor de riesgo que puede causar autismo o esquizofrenia al feto (Ciaranello 1995, Atladottir 2010, Brown 2012). La intensidad y la duración de la activación inmune y la expresión de citocinas parecen ser factores importantes que influyen en el riesgo de padecer autismo (Meyer 2014). La activación inmunitaria intensa se asocia con un mayor riesgo de autismo en el feto (Careaga 2017, Atladottir 2010). La inflamación crónica se asocia con un mayor riesgo de autismo (Jones 2016, Zerbo 2014). El momento de la activación inmune en relación con las etapas del desarrollo del cerebro es también un factor importante (Meyer 2006, Meyer 2009).
Las citocinas son un grupo de proteínas y glucoproteínas producidas por diversos tipos celulares que actúan fundamentalmente como reguladores de las respuestas inmunitaria e inflamatoria. ver más
Los experimentos con animales han probado los efectos de la activación inmune durante el embarazo y después del nacimiento en el desarrollo de las crías (Meyer 2009, Deverman 2009, Estes 2016, Kneusel 2014, Careaga 2017, Meyer 2014). En estos experimentos, los animales preñados o neonatos (ratones, ratas y monos) son inyectados con sustancias de activación inmune no infecciosas tales como “poli-IC” (que imita una infección viral) o lipopolisacárido (LPS, que imita una infección bacteriana). Estas sustancias causan la activación del sistema inmune sin infección. Inducen la fiebre y la producción de citocinas y pueden tener efectos sustanciales sobre el desarrollo del cerebro si la activación es suficientemente intensa o prolongada y si la exposición se produce durante las etapas vulnerables de desarrollo .
El ácido policitidílico (generalmente abreviado poli IC o poli (I: C)) es un inmunoestimulante. Se utiliza en forma de sal de sodio para simular infecciones virales.
Se ha demostrado que la activación inmunitaria en ratones causa los tres síntomas de comportamiento principales del autismo: disminución de
la socialización, disminución de la comunicación y aumento de las conductas repetitivas (Malkova 2012). También se ha demostrado que la activación inmunitaria causa neuropatología (Weir 2015) y anormalidades del comportamiento en monos que se asemejan a las conductas en la esquizofrenia y el autismo humano (Bauman 2014, Machado 2015).
La activación inmune también causa comportamientos
no asociados con el autismo (citas que vinculan la activación inmune
con estos efectos):
- Reducción de las células de Purkinje (Shi 2009);
- Disfunción mitocondrial (Giulivi 2013);
- Incremento del volumen cerebral (por la exposición de la IL-6, Wei 2012 (b)) y densidad de las neuronas en el cerebro (Smith 2012);
- Inflamación cerebral crónica a largo plazo (Garay 2013); y
- Interrupción del microbioma (disbiosis) (Hsiao 2013).
La Interleucina-6, IL-6 es responsable de causar efectos en el comportamiento semejantes a los del autismo por la activación inmune
El laboratorio Patterson de CalTech fue el primero en informar que la IL-6, Interleucina-6, es responsable de causar efectos en el comportamiento semejantes a los del autismo por la activación inmune (Smith 2007). Dos estudios de este grupo explican:
“La IL-6 es central para el proceso por el cual la activación inmune materna provoca alteraciones del comportamiento a largo plazo en la descendencia.”(Smith 2007)
“… el bloqueo de la IL-6 previene> 90% de los cambios observados en la descendencia de poli (I: C) – inyectado en hembras que muestran cambios en la expresión génica , así como cambios de comportamiento que se normalizan mediante la eliminación de la IL-6 de la respuesta inmune materna.” (Smith 2007)
“La IL-6 es necesaria y suficiente para mediar estos efectos ya que los efectos son prevenidos mediante la inyección de ratones embarazadas con poli-IC combinados con un anticuerpo anti-IL-6, y son imitados por una sola inyección materna de la IL-6. ”(Garay 2013)
La exposición del cerebro a elevada IL-6 por el virus de ingeniería demostró que la exposición a IL-6 , iniciada después del nacimiento, causa comportamientos parecidos a los del autismo (Wei 2012 (a)). Wei 2012 (a) los estudios de Wei aclaran:
“Hemos demostrado que la IL-6 es un mediador importante de comportamientos semejantes a los del autismo. Los ratones con elevada IL-6 en el cerebro desarrollan comportamientos parecidos a los del autismo, incluyendo deterioro de la capacidad cognitiva, déficit en el aprendizaje, ansiedad y habituación, así como una disminución de la interacción social que se inicia en etapas posteriores. Estos hallazgos sugieren que un aumento de la IL-6 en el cerebro podría modular ciertas alteraciones patológicas y contribuir al desarrollo del autismo.”(Wei 2012 (a))
Una evidencia más reciente muestra que la IL-17 actúa aguas abajo de la IL-6 para causar conductas anormales como en el autismo y un desarrollo cortical atípico en ratones (Choi 2016). El bloqueo de la IL-6 o IL-17 impide el comportamiento similar al autismo; una inyección de IL-17 por sí misma causa el comportamiento tipo autismo (Choi 2016). Se sabe que la IL-6 induce la IL-17 mediante la promoción del desarrollo de células Th17 que producen IL-17.
Los modelos animales de activación inmune parecen ser modelos válidos para los trastornos neurológicos / humanos psiquiátricos, incluyendo el autismo (Estes 2016, Careaga 2017, Meyer 2014). La revisión Estes 2016 argumenta a favor de la validez de los modelos de activación inmune con los seres humanos:
“La MIA (activación inmune materna) con modelos en animales cumple todos los criterios requeridos para la validez de un modelo de enfermedad: imita un conocido factor de riesgo relacionado al modelo de enfermedad (validez de constructo), exhibe una amplia gama de síntomas relacionados con la enfermedad (validez aparente), y puede ser usadoa para predecir la eficacia de los tratamientos (validez predictiva).”(Estes 2016 )
La evidencia sugiere un papel mediador para la IL-6 y la IL-17 en el autismo . Por ejemplo, la IL-6 es significativamente elevada en el cerebelo de las personas con autismo (Wei 2011), y es altamente elevada en algunas regiones del cerebro de algunos individuos con autismo (Vargas 2005). El tratamiento de casos de autismo con luteolina, flavonoide antiinflamatorio mejora los comportamientos en personas con autismo que también experimentan una disminución en los niveles de la IL-6 de la sangre (Tsilioni 2015). Este resultado es consistente con un papel causal para la IL-6 en el autismo . Además, la IL-17 se eleva en el autismo (Akintunde 2015, Al-Ayadhi 2012, Suzuki 2011). La vitamina D reduce la producción de IL-17 (Bruce 2011, Wöbke 2014, Drozdenko 2014) y mejora las conductas autistas en los seres humanos (Saad 2016, Jia 2015). Los hallazgos de vitamina D son consistentes con un papel causal para la IL-17 en el autismo.
A. Kimberley McAllister, Science 26 Feb 2016: Vol. 351, Issue 6276, pp. 919-920 DOI: 10.1126/science.aaf2850
El funcionamientode la IL-6 parece ser similar o idéntico en ratones y seres humanos. No hay diferencias humanas del ratón en el funcionamiento de la IL-6 descriptas en una revisión del 2004 (Mestas 2004). El funcionamiento de la IL-6 se conserva a través de las especies (Brown 2014). el desarrollo del sistema nervioso central en roedores y humanos se rige por los mismos principios (Brown 2014). Por lo tanto, el hecho de que la IL-6 provoca autismo como anormalidades del comportamiento en modelos animales merece una presunción de validez a los seres humanos.
La activación inmunitaria es un factor de riesgo para el autismo, esquizofrenia y otros trastornos neurológicos / psiquiátricos. Las citocinas IL-6 e IL-17 son responsables de la mediación de los efectos de comportamiento parecidos al autismo de activación inmune en los modelos animales. La evidencia disponible apoya un papel causal para la IL-6 y IL-17 en el autismo humano.
La vacunación postnatal afecta el desarrollo cerebral en un modelo animal
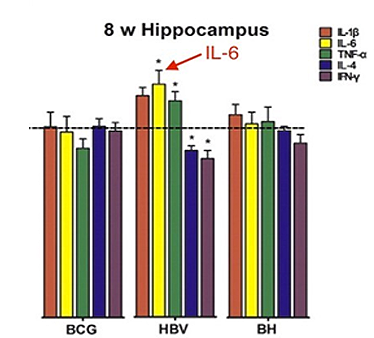
El primer estudio para probar el efecto de la vacunación postnatal en el desarrollo del cerebro fue publicado en 2015 (Li 2015). En este experimento, las ratas neonatales fueron administradas con la vacuna Bacillus Calmette-Guérin (BCG) y la vacuna contra la hepatitis B (VHB) o una combinación (BCG + HBV) programado para imitar los calendarios de vacunación infantil humanos. La vacunas BCG y VHB producen efectos opuestos en el cerebro. Específicamente, la BCG afecta la plasticidad sináptica (LTP, la base de aprendizaje y la memoria); HBV inhibe la plasticidad sináptica y la LTP. También causaron cambios opuestos en algunos niveles de proteína sináptica.
LTP (Long-term potentiation) es un proceso por el cual las conexiones sinápticas entre las neuronas se fortalecen con la activación frecuente. Se cree que LTP es una forma en que el cerebro cambia en respuesta a la experiencia y, por lo tanto, puede ser un mecanismo subyacente al aprendizaje y la memoria.
La plasticidad sinaptica o neuronal es la capacidad del cerebro de reconstruirse de aprender y recordar. En la literatura existe amplia evidencia de que la experiencia promueve modificaciones en la estructura sináptica, particularmente en regiones como el hipocampo.
La vacuna contra el VHB (pero no la vacuna BCG) aumentó la expresión génica de la IL-6 en el cerebro; aumento de la expresión de genes probablemente indica una elevación en el cerebro de IL-6. La vacuna contra el VHB contiene el adyuvante de aluminio, y la BCG no contiene adyuvante de aluminio. Por lo tanto, el adyuvante de aluminio puede ser el ingrediente responsable de la expresión génica elevada IL-6 .
La expresión génica es el proceso mediante el cual la información codificada en un gen se utiliza para dirigir el montaje de una molécula de proteína.
El estudio Li et al demostró que las vacunas causaron otros cambios en el cerebro, incluyendo 1) los cambios en la potenciación a largo plazo (LTP) (Hep B disminuyó LTP), 2) cambios en las espinas dendríticas, y 3) cambios en la expresión de proteína sináptica. Los cambios en las proteínas de la sinapsis y espinas dendríticas se han observado en los trastornos del cerebro humano.
Li et al atribuyen los efectos cerebrales a los cambios en los niveles de citoquinas y la polarización inmune (polarización Th1 / Th2) inducida por el adyuvante de aluminio en las vacunas que causan la polarización Th2.
Li et al declaran que los resultados sugieren que las vacunas pueden interactuar a través de efectos de activación inmune:
“… nuestros datos sugieren que las combinaciones de diferentes vacunas pueden interactuar entre sí (potenciar o contrarrestar). El mecanismo de modulación de la plasticidad sináptica a través de BCG neonatal / vacuna contra el VHB puede ser a través sistémica sesgo Th1 / Th2 acompañado de un perfil específico de citoquinas y las neurotrofinas en el cerebro.”(Li 2015)
Li 2015 demuestra que las vacunas afectan el desarrollo del cerebro por un mecanismo de activación inmune. Además, el adyuvantes de aluminio puede inducir la activación de Th2 y polarización largo plazo de Th2. Los resultados de Li 2015 sugieren que todas las vacunas con adyuvante de aluminio, pueden causar efectos adversos similares a la vacuna contra el VHB. En consecuencia, los resultados de Li 2015 sugieren que los estudios muestran que la activation inmune provoca trastornos neurológicos / psiquiátricos relacionados a los efectos adversos de la vacuna.
Las vacunas se administran Durante Synaptogenesis
Otra manera de responder a la cuestión de la vulnerabilidad del cerebro a la activación inmune es tener en cuenta los tipos de procesos de desarrollo del cerebro que ocurren cuando se administran las vacunas. Las vacunas se administran principalmente en los primeros 18 meses de vida. El cerebro humano se somete a un rápido e intenso desarrollo durante este período. Synaptogenesis (formación de conexiones sinápticas entre neuronas) es especialmente intenso en este periodo.
La vulnerabilidad del cerebro en desarrollo a la activación inmune esta aparentemente relacionada con los tipos específicos de los procesos de desarrollo del cerebro que ocurren (Tau 2010, Meyer 2006, Meyer 2007). Tales procesos incluyen la migración (movimiento de las neuronas a ubicaciones finales en el cerebro), la adhesión (formación de adhesiónes químico-mecánicas entre las células cerebrales), y la sinaptogénesis (formación de conexiones sinápticas entre neuronas), entre otros (neurogénesis, gliogenesis, mielinización, etc).
Las citoquinas afectan a los procesos de desarrollo del cerebro. Por ejemplo, elevada IL-6 afecta a la migración, adhesión y sinaptogénesis (Wei 2011). La IL-6 elevada en el periodo postnatal promueve un exceso de sinapsis excitadoras y un déficit de sinapsis inhibidoras, y media comportamientos parecidos al autismo (Wei 2012 (a)).
En los seres humanos, un aumento dramático en la sinaptogénesis comienza alrededor del momento del nacimiento, y continúa hasta aproximadamente los 3 años (Huttenlocher 1997, Tau 2010, Stiles 2010, Semple 2013). Las vacunas se administran durante esta intensa sinaptogénesis. Ver figura 5.
Un IL-6 elevado en el cerebro inducido por la vacunación durante la sinaptogénesis puede causar un desequilibrio excitatorio-inhibidor, desequilibrado cuasando excitación. Un desequilibrio excitatorios se ha observado en el autismo humano.
(Robertson 2016, Freyberg 2015)

Adyuvantes de aluminio: neurotóxicos a dosis de vacuna
Los adyuvantes de aluminio (Al) tienen un papel esencial en muchas vacunas que es estimular la activación inmune. Sin adyuvantes de aluminio las vacunas tendrían una eficacia muy reducida.
Los adyuvantes de aluminio comprenden partículas submicrónicas (partículas primarias) de compuestos de aluminio, típicamente AlOH, AlPO4, AlSO4 o una combinación de estas. Las partículas primarias típicamente se aglomeran en partículas más grandes con tamaños de alrededor de 2-20 micrones (Harris 2012). Las partículas de adyuvantes de aluminio tienen baja solubilidad en agua y fluidos corporales. Las partículas de adyuvantes de aluminio son biopersistentes y pueden permanecer en el cuerpo durante meses o años (Flarend 1997, Khan 2013, Gherardi 2001).
El aluminio ingerido versus el aluminio inyectado a través de las vacunas
El aluminio que se ingiere a través de los alimentos tiene baja absorción oral (aproximadamente 0,3%), se excreta rápidamente por los riñones, es (en su mayoría) excluido del cerebro por la barrera sangre-cerebro, y está en una forma iónica Al3 + solubilizada (no partículas). Estas defensas son adecuadas para la protección del cerebro a partir de los niveles naturales de exposición de aluminio. Pero estos mecanismos de protección no son capaces de proteger al cerebro de partículas de aluminio inyectado. Las partículas del adyuvante aluminio son demasiado grandes como para ser eliminadas por los riñones y pasan a través de la barrera hematoencefálica transportada por los macrófagos.
Las dosificaciones de los adyuvantes de aluminio recibidas por los niños de acuerdo con el calendario de vacunación del CDC son:
Nacimiento (Hep B):
74 mcg / kg (250 mcg por 3,4 kg para bebé)
2 meses:
245 mcg / kg (1.225 mcg para 5 kg para bebé)
4 meses:
150 mcg / kg (975 mcg por 6,5 kg para bebé)
6 meses:
153 mcg / kg (1,225 mcg por 8 kg para bebé)
Estas son dosis máximas-posibles (porque las diferentes vacunas tienen diferentes cantidades) para los niños de peso promedio.
Varias pruebas científicas demuestran que los adyuvantes de aluminio tienen efectos neurológicos adversos a dosis más bajas que o similares a las dosificaciones que los lactantes reciben en las vacunas. Estos efectos parecen depender de la naturaleza de partículas y biopersistencia del adyuvante de aluminio. Inyectado Al adyuvante tiene efectos adversos que están aparentemente mediados por las partículas e iones independientes solubilizados Al3 + liberadas por la disolución lenta de partículas. (Crepeaux 2017).
Las inyecciones con adyuvante de aluminio en ratones causan efectos adversos a dosis de vacuna de 100, 200, 300 y 550 mcg / Kg de peso corporal (Crepeaux 2017, Shaw 2009, Petrik 2007, Shaw 2013). Estos incluyen déficit en el aprendizaje y la memoria (Shaw 2009), déficit en la fuerza / función neuromuscular (Petrik 2007), y cambios en la actividad locomotora y / o de la marcha (Shaw 2009, Shaw 2013). El autismo se asocia con alteraciones de la marcha y el movimiento (Kindregan 2015) y disfunción de la memoria (Williams 2006).
Dosis de adyuvante Al de 200 mcg / kg (como3 x 66mcg / Kg) (Crepeaux 2017) y 300 mcg / Kg (como 6 x 50 mcg / Kg) (Shaw 2009) aumentó la activación microglial en el prosencéfalo ventral y la médula espinal lumbar, respectivamente. La activación microglial elevada se midió alrededor de 6 meses después de la inyección adyuvante Al, lo que sugiere que la activación microglial es crónica. La Microglia activada indica un proceso inflamatorio en curso y sugieren la presencia de citocinas elevadas. Los casos de autismo de humanos tienen microglia activada y citoquinas elevadas en todo el cerebro (Vargas 2005, Suzuki 2013, Li 2009).
La microglia activada está implicada como un factor causal en el autismo, ya que la microglía media la inflamación en el cerebro. La microglía puede producir IL-6 cuando está en un estado activado. Una revisión reciente sobre la microglía y el autismo (Takano 2015) afirma:
“… cualquier factor que altere el número o estado de activación de la microglía, ya sea en el útero o durante el período postnatal temprano pueden afectar profundamente el desarrollo neuronal, lo que resulta en trastornos del desarrollo neurológico, incluyendo el autismo.” (Takano 2015)
La microglía parece jugar un papel importante en la etiología del autismo (Takano 2015, Kneusel 2014). Por lo tanto, la activación microglial causada por adyuvantes de aluminio sugiere un papel en el autismo.
Varios estudios muestran que los adyuvantes de aluminio aumentan el contenido de aluminio del cerebro (Crepeaux 2017, Flarend 1997, Shaw 2009, Khan 2013, Crepeaux 2015). Una dosis de 200 mcg / Kg Al adyuvante causó un aumento de 50 veces en el contenido de aluminio en el cerebro de ratones, a partir de 0,02 ug / g a 1,0 ug / g de peso seco de cerebro (Crepeaux 2017). Estas mediciones se realizaron 6 meses después de la inyección final, que indica que el Al persiste en el cerebro a largo plazo (Crepeaux 2017). Se han encontrado que el adyuvante de Al puede acumularse en el cerebro de los ratones hasta un año después de la inyección (Khan 2013). Crepeaux 2015 demostró la persistencia y la creciente acumulación de partículas del adyuvantes de Al hasta 270 días en el bazo y los ganglios linfáticos de ratones. El aumento de la acumulación de aluminio en diferentes órganos del cuerpo sugiere que con el tiempo los efectos tóxicos pueden aumentar y podrán desarrollarse meses o años después de haber sido inyectados.
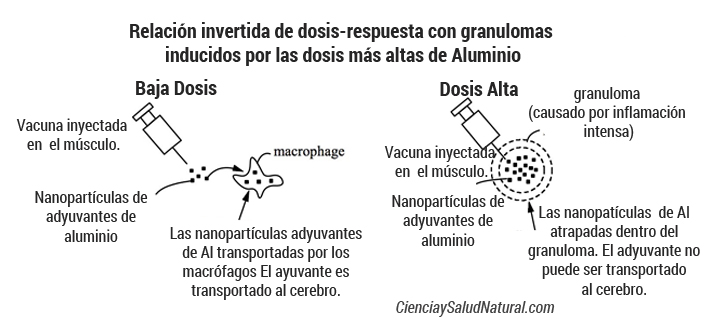
El adyuvante de aluminio puede ser transportado a todo el cuerpo
Los 400 y 800 mcg / kg de dosis utilizados en el estudio Crepeaux 2017 no causaron efectos adversos ni elevaron el aluminio en el cerebro. Los autores atribuyen esta relación dosis-respuesta invertida sorprendente a granulomas inducidos por las dosis más altas. Las Granulomas interceptan el adyuvante de aluminio en el sitio de inyección, evitando de este modo su transporte al cerebro y a otros tejidos sensibles. Los granulomas se producen después de aproximadamente 1% de vacunas (Bergfors 2014). Esto es motivo de preocupación ya que indica que, para el 99% de las vacunas, el adyuvante de auminio puede ser transportado a todo el cuerpo. No se limita a un granuloma.
Los adyuvantes de aluminio pueden ser transportados al cerebro por los macrófagos
Los adyuvantes de aluminio pueden llegar al cerebro (Khan 2013, Crepeaux 2015, Crepeaux 2017, Shaw 2009, Flarend 1997). Partículas de adyuvantes de aluminio pueden pasar a través de la barrera hematoencefálica del cerebro, transportadas por los macrófagos (Khan 2013). El transporte es promovido por la proteína quimiotáctica-1 (MCP-1) de los macrófagos (Khan 2013). El transporte de partículas al cerebro por los macrófagos está bien establecido y se ha investigado para aplicaciones terapéuticas. (Choi 2012, Pang 2016).
La cantidad de MCP-1 es elevada en los cerebros de los casos de autismo humanos (Vargas 2005) y se eleva en la sangre de los recién nacidos más tarde con diagnóstico de autismo (Zerbo 2014). Esto sugiere que los recién nacidos con alta MCP-1 experimentarán un transporte elevado del adyuvante de Al en el cerebro cuando sean inyectados con vacunas con adyuvante de Al. Esto es consistente con adyuvantes de Al, causar autismo mediante la inducción de la activación inmune y elevadar niveles de citocinas en el cerebro
El Aluminio induce la expreción IL-6 (Interleucina-6) en el cerebro
La IL-6 es una citocina multifuncional que puede influir sobre las funciones de una amplia variedad de células y procesos fisiológicos. La IL-6 es un punto crítico en la red de citocinas inflamatorias. En condiciones de autoinmunidad e inflamación crónica, los niveles elevados de IL-6 pueden afectar a la homeostasis de múltiples procesos fisiológicos y contribuir a la inflamación crónica y progresión de la enfermedad.
Sales de aluminio solubles en agua (por ejemplo, AlCl3, Al lactato) inducen elevada de IL-6 en el cerebro y en otros tejidos. De hecho, el aluminio parece inducir IL-6 selectivamente (Viezeliene 2013). Los estudios de exposición de aluminio y expresión IL-6 en el cerebro incluyen:
Cao 2016: La ingestión de 30 o 90 mg / kg / día de aluminio (como AlCl3) durante 90 días aumentó significativamente la expresión del gen de IL-6 y otras citoquinas en el cerebro (hipocampo).
Alawdi 2016: La ingestión de 3,4 mg/día/kg de aluminio (AlCl3) durante 6 semanas causó un aumento de 4 veces en IL-6 en el cerebro (hipocampo). Esta dosificación es mucho más baja que el ya obsoleto umbral de toxicidad que dice “no se observan efectos adversos en este nivel” (NOAEL) dosis orales de (26 y 62 mg / kg / día) que se utilizan como puntos de referencia para umbral de toxicidad (Mitkus 2011, Offit 2003).
De hecho, otros experimentos muestran que las dosis orales de 3.4, 4, 5.6, 6, y 20.2 mg / kg / día de aluminio causan numerosos efectos adversos en ratones o ratas, por lo tanto el NOAEL para ingerir por vía oral de aluminio es actualmente desconocido (Alawdi 2016, Dera 2016, Sethi 2008, 2009 Sethi, Bilkei-Gorzo 1993).
La inducción de IL-6 se puede producir porque el aluminio induce fuertemente el estrés oxidativo (Exley 2003). El estrés oxidativo induce IL-6 expresión (Viezeliene 2013).
Estudio Fatalmente Defectuoso de Al adyuvantes (Mitkus 2011) publicado en el sitio del CDC
Las dosis de adyuvantes de aluminio recibidos por los niños aumentaron dramáticamente a medida que el calendario de vacunación se amplió en los años 1980 y 1990. Sin embargo, la seguridad de las dosis crecientes de adyuvantes de aluminio no fue probada. Las agencias gubernamentales (HHS, NIH, CDC, FDA) no han hecho ningún nuevo trabajo experimental sobre la toxicidad del adyuvante de aluminio.
Para justificar la seguridad de los adyuvantes de aluminio con las dosis más altas de hoy en día, los CDC citan un estudio de 2011 de la FDA sobre la exposición de aluminio de las vacunas (Mitkus 2011). Este estudio es la única evidencia científica citada por los sitios web de los CDC y la FDA que apoya la seguridad de los adyuvantes de aluminio.
El Mitkus 2011 es un estudio de modelado teórico de la cinética del adyuvante de aluminio que no contiene nuevos datos relativos a la toxicidad del adyuvante de aluminio (a partir de modelos de animales o epidemiologicos). Mitkus 2011 calcula una carga corporal de aluminio resultante de la disolución lenta de las partículas del adyuvante, y compara la carga corporal- aluminio disuelto a un “nivel de riesgo mínimo” (MRL). El MRL se deriva de un estudio de toxicidad de aluminio ingerido en ratones (Golub 2001). El estudio Golub 2001 proporciona el NOAEL (26 mg / kg / día que se ingiere), que se convierte en el MRL para bebés humanos (en base a 1 mg / kg / día ingerido) mediante el uso de un factor de seguridad de alrededor de 30. El estudio Mitkus tiene fallas fatales por estas razones:
- Mitkus asume que las particulas del adyuvante de aluminio son inofensivas
Mitkus hace una suposición implícita de que el adyuvantes de aluminio en forma de partículas tienen toxicidad cero. Mitkus sólo considera la toxicidad potencial de los iones de aluminio (Al3 +) liberados por la disolución lenta de partículas del adyuvante de aluminio .
Los adyuvantes de aluminio contienen una baja solubilidad y biológicamente persistentes partículas microscópicas . En el análisis, Mitkus asume que las partículas son absolutamente no tóxicas y perfectamente inofensivas, incluso cuando están presentes en el cerebro y en otros órganos. Mitkus no ofrece ninguna justificación para esta suposición no declarada. Además, el supuesto se contradice con hallazgos recientes sobre la toxicidad del adyuvante de aluminio ( Crepeaux 2017 ) y la toxicidad de partículas en general. Las partículas pueden tener efectos tóxicos mediados por la química de la superficie (por ejemplo, carga superficial y la actividad catalítica de superficie) y por la forma de las partículas, entre otras características de las partículas sólidas (Sharifi 2012, Podila 2013).
Varios estudios muestran adyuvantes de aluminio inyectados que causan anormalidades de comportamiento, aumento anormal de peso, problemas de aprendizaje y deterioro de la memoria, de neuronas motoras de la muerte / apoptosis, los déficit de fuerza neuromusculares, la activación microglial crónica / inflamación del cerebro, y en casos aumento del contenido de aluminio (por ejemplo, 50X) en el cerebro y de la médula espinal (Petrik 2007, Shaw 2009, Shaw 2013, Crepeaux 2017). Estos efectos adversos se producen a dosis menores o similares a las dosis recibidas por los niños de acuerdo con el calendario de vacunación del CDC.
2. Nuevas investigaciones demuestran que el aluminio ingerido en dosis más bajas que 26 mg/kg/día son nocivas
Mitkus asume que la toxicidad adyuvante de aluminio está mediada exclusivamente Al solubilizado (iones Al3 +) liberadas por las partículas de adyuvante de Al que se disuelven lentamente. Al establecer un nivel de umbral de toxicidad del aluminio solubilizado, Mitkus se basa en un estudio de alimentación de ratón (Golub 2001) que reporta que no se “observada nivel de efectos adversos” (NOAEL) con una dosificación oral de 26 mg / Kg / día ingerido aluminio. Mitkus utiliza un factor de seguridad 30X para la aplicación de esta dosis para los seres humanos, que es razonable.
Sin embargo, otros experimentos muestran que mucho más bajas las dosis orales de 3.4, 4, 5.6, 6, y 20.2 mg / Kg / día de aluminio causan efectos adversos en ratones o ratas (Alawdi 2016, Dera 2016, Sethi 2008, Sethi 2009, Bilkei-Gorzo 1993). Los efectos adversos incluyen inflamación crónica del cerebro, el aprendizaje y deterioro de la memoria, y la inflamación del riñón. Por lo tanto, el análisis Mitkus está mal porque 26 mg / kg / día no es un NOAEL. El NOAEL (Lowest observed adverse effect level), es un índice de toxicidad que se determina en el proceso de «evaluación toxicológica», y a partir de él se deriva el resto de parámetros de toxicidad. El “nivel de riesgo mínimo” (MRL) determinado por Mitkus es demasiado alto en un factor de al menos 26 / 3,4 = 7,6. Si en vez se usa un NOAEL con resultados corregidos de 3.4 mg / Kg / día (basado en Alawdi 2016) en la exposición de aluminio en vacunas se excede el MRL para el adyuvante AlPO4 , y coincide aproximadamente al MRL del adyuvante AlOH. Las nuevos, líneas corregidas del MRL indican que adyuvante de Al fosfato (Fig. 12) y adyuvante de hidróxido de Al del calendario del CDC puede causar toxicidad por el Aluminio solubilzado per se.
3. No se citan datos de toxicidad ha pesar de que hay datos disponibles
Mitkus no cita ninguna información de toxicidad para los adyuvantes de aluminio inyectados. En su lugar utiliza los datos de toxicidad para la ingestión de aluminio no particulada, soluble en agua, (Golub 2001, que utiliza Al lactato) para derivar el MRL . Estos datos provienen de un único estudio (Golub 2001).
Así, sorprendentemente, Mitkus reivindica un nivel seguro de exposición al adyuvante de aluminio inyectado, sin citar ningún dato de toxicidad. El error es negligente porque existen al menos dos estudios en animales sobre la toxicidad del adyuvante de aluminio inyectado y estaban disponibles antes de la publicación de Mitkus en 2011 (Petrik 2007, Shaw 2009). Estos documentos no fueron citados ni mencionados por Mitkus 2011.
Cada uno de estos tres defectos es fatal para la validez del estudio de Mitkus en el establecimiento de la seguridad de los adyuvantes de aluminio. Por lo tanto, el CDC carece por completo pruebas válidas para la seguridad del adyuvante de Al. Esto es especialmente cierto para la seguridad en relación con los resultados neurológicos y largo plazo, ya que otros estudios disponibles sobre la seguridad del adyuvante de Al (por ejemplo, Jefferson 2004) no consideran (o son incapaces de detectar) estos resultados.
CDC no investiga la toxicidad de lo adyuvantes de aluminio Al
El CDC ha realizado estudios epidemiológicos sobre la seguridad a largo plazo (por ejemplo, teniendo en cuenta los resultados neurológicos) del adyuvante de Al. Hay un estudio de datos a nivel de país, que informó de una asociación entre la exposición de adyuvante de Al y el autismo (Tomljenovic 2011). Sin embargo, siendo un estudio ecológico, es altamente susceptible a la confusión y sesgos.
Dr. Frank DeStefano de la Oficina de Seguridad de Inmunización de los CDC es co-autor de un estudio de viabilidad (Glanz 2015) y uso el Vaccine Safety Datalink (VSD) para investigar la seguridad de los ingredientes individuales de las vacunas. El documento se centra en adyuvantes de Al. Se reconoce que el timerosal es el único ingrediente de la vacuna estudiada para el autismo o la seguridad neurológica, y que una posible asociación entre adyuvantes de Al y el autismo no se ha explorado en los estudios epidemiológicos. Glanz 2015 establece lo siguiente:
“Hasta la fecha, no ha habido estudios poblacionales específicamente diseñados para evaluar las asociaciones entre resultados clínicamente significativos y los ingredientes no antígeno, distintos de timerosal.”
El CDC no ha investigado las preocupaciones de seguridad de adyuvantes de Al, a pesar de la evidencia científica acumulada de daño y evidencia que vincula estos adyuvantes a los mecanismos de activación inmune y de daño cerebro. Sin embargo, el documento Glanz señala que los estudios de adyuvantes de aluminio son problemáticos debido a pequeñas diferencias esperadas en adyuvantes, en particular en relación con el autismo y otros resultados neurológicos a largo plazo.
Conclusión
La ciencia demuestra una coherente y convincente realidad: las vacunas pueden causar autismo mediante la estimulación de la activación inmune y provocar una elevada cantidad de citoquinas en el cerebro. Los adyuvantes de Al están implicados como causa de autismo debido a que pueden ser transportados al cerebro, y causar la activación microglial con las dosis de vacunas y porque el aluminio induce IL-6 en el cerebro.
Sobre las declaraciones que afirman que no existe ningún vínculo entre el autismo y las vacunas, los CDC citan evidencia científica que no es relevante para la seguridad del adyuvante de aluminio o es incapaz de refutar la relación con el autismo causada por estos adyuvantes (Taylor 2014, DeStefano 2013, Mitkus 2011). En apoyo de solicitudes de seguridad de los adyuvantes de aluminio, el CDC se basa en un estudio de modelado teórico con fallas significativas (Mitkus 2011). Hay una pobre evidencia científica que apoya la seguridad de los adyuvantes de aluminio y ningún interés de los CDC en investigar como se debería.
Referencias:
- Akintunde et al., 2015 Increased production of IL-17 in children with autism spectrum disorders and co-morbid asthma, Journal of Neuroimmunology 286 (2015) 33-41.
- Al-Ayadhi et al., 2012 Elevated serum levels of interleukin-17A in children with autism, Journal of Neuroinflammation 2012, 9:158.
- Alawdi et al., Neuroprotective Effect of Nanodiamond in Alzheimer’s Disease Rat Model: a Pivotal Role for Modulating NF-κB and STAT3 Signaling, Molecular Neurobiology, 54 (3):1906-1918.
- Atladottir et al., Maternal infection requiring hospitalization during pregnancy and autism spectrum disorders, Journal of Autism and Developmental Disorders, 2010 Dec;40(12):1423-1430.
- Bauman et al., 2014 Activation of the Maternal Immune System During Pregnancy Alters Behavioral Development of Rhesus Monkey Offspring, Biological Psychiatry, 2014;75: 332–341
- Bergfors et al., 2014 How common are long-lasting, intensely itching vaccination granulomas and contact allergy to aluminium induced by currently used pediatric vaccines? A prospective cohort study, European Journal of Pediatrics, 173:1297–1307.
- Bilkei-Gorzo, 1993, Neurotoxic effect of enteral aluminum, Food and Chemical Toxicology, 31(5):357-361.
- Brown et al., 2014 Metabolic consequences of interleukin-6 challenge in developing neurons and astroglia, Journal of Neuroinflammation, 11:183.
- Brown et al., Epidemiologic studies of exposure to prenatal infection and risk of schizophrenia and autism, Developmental Neurobiology, 2012 October ; 72(10): 1272–1276.
- Bruce et al., 2011 Converging pathways lead to overproduction of IL-17 in the absence of vitamin D signaling, 2011 Aug; 23(8): 519–528.
- Careaga et al 2017 Maternal Immune Activation and Autism Spectrum Disorder: From Rodents to Nonhuman and Human Primates, Biological Psychiatry, March 1, 2017; 81:391–401. Chen et al., Postnatal systemic inflammation exacerbates impairment of hippocampal synaptic plasticity in an animal seizure model, Neuroimmunomodulation, 2013;20(4):223-32.
- Choi et al., 2012, Delivery of nanoparticles to brain metastases of breast cancer using a cellular Trojan horse, Cancer Nanotechnology, 3:47–54.
- Choi et al., 2016 The maternal interleukin-17a pathway in mice promotes autismlike phenotypes in offspring, Science, 2016 Feb 26; 351(6276): 933–939.
- Ciaranello et a The Neurobiology of Infantile Autism, The Neuroscientist, 1:361-367
- Coiro et al., Impaired synaptic development in a maternal immune activation mouse model of neurodevelopmental disorders, Brain, Behavior, and Immunity, Nov;50:249-258.
- Crepeaux et al., 2015 Highly delayed systemic translocation of aluminum-based adjuvant in CD1 mice following intramuscular injections, Journal of Inorganic Biochemistry, 152:199-205.
- Crepeaux et al., 2017 Non-linear dose-response of aluminium hydroxide adjuvant particles: Selective low dose neurotoxicity, Toxicology, 375 (2017) 48–57.
- DeLong et al., 1981 Acquired reversible autistic syndrome in acute encephalopathic illness in children, Archives of Neurology, 36:191-194.
- Dera 2016, Protective effect of resveratrol against aluminum chloride induced nephrotoxicity in rats, Saudi Medical Journal, 37 (4).
- DeStefano et al., 2013 Increasing Exposure to Antibody-Stimulating Proteins and Polysaccharides in Vaccines Is Not Associated with Risk of Autism, The Journal of Pediatrics, 163 (2).
- Deverman and Patterson, 2009 Cytokines and CNS Development, Neuron 64:61-78.
- Drozdenko et al., 2014 Oral vitamin D increases the frequencies of CD38+ human B cells and ameliorates IL-17-producing T cells, Experimental Dermatology, 23: 107-112.
- Estes and McAllister, 2016 Maternal immune activation: implications for neuropsychiatric disorders, Science, 353 (6301) 772-777.
- Exley, 2003 The Pro-Oxidant Activity of Aluminum, Free Radical Biology and Medicine, 36(3): 380-387.
- Flarend et al., 1997 In vivo absorption of aluminum-containing vaccine adjuvants using 26 Al, Vaccine, 15(12/13):1314-1318.
- Freyberg et al., 2015 Reduced perceptual exclusivity during object and grating rivalry in autism, Journal of Vision, 15(13):11, 1–12.
- Galic et al., 2008 Postnatal Inflammation Increases Seizure Susceptibility in Adult Rats, The Journal of Neuroscience, 2008, 28 (27) 6904-6913.
- Garay et al., 2013 Maternal immune activation causes age- and region-specific changes in brain cytokines in offspring throughout development, Brain, Behavior, and Immunity, 31: 54- 68.
- Ghaziuddin et al., 2002 Autistic symptoms following herpes encephalitis, European Child and Adolescent Psychiatry, Vol. 11, No. 3:142-146.
- Gherardi et al., 2001 Macrophagic myofasciitis lesions assess long-term persistence of vaccine-derived aluminium hydroxide in muscle, Brain, 124:1821-1831.
- Ghiani et al., 2011 Early effects of lipopolysaccharide induced inflammation on foetal brain development in rat, ASN Neuro, 3 (4): 233-245.
- Gillberg 1986 Brief Report: Onset at Age 14 of a Typical Autistic Syndrome. A Case Report of a Girl with Herpes Simplex Encephalitis, Journal of Autism and Developmental Disorders, VoL 16, No. 3:369-375.
- Giulivi et al 2013 Gestational Exposure to a Viral Mimetic Poly(I:C) Results in Long- Lasting Changes in Mitochondrial Function by Leucocytes in the Adult Offspring, Mediators of Inflammation, Vol 2013:609602.
- Glanz et al., 2015, Cumulative and episodic vaccine aluminum exposure in a population- based cohort of young children, Vaccine 33:6736–6744.
- Golub et al., 2001 Long-term consequences of developmental exposure to aluminum in a suboptimal diet for growth and behavior of Swiss Webster mice, Neurotoxicology and Teratology 23 (2001) 365–372.
– - Gupta et al., 1998 Th1- and Th2-like cytokines in CD4+ and CD8+ T cells in autism, Journal of Neuroimmunology, 85:106-109.
- Harre et al., 2008 Neonatal inflammation produces selective behavioural deficits and alters N-methyl-D-aspartate receptor subunit mRNA in the adult rat brain, European Journal of Neuroscience, 2008 Feb; 27(3): 644–653.
- Harris et al., 2012 Alhydrogel® adjuvant, ultrasonic dispersion and protein binding: A TEM and analytical study, Micron, 43:192-200.
- Hsiao et al., 2013 The microbiota modulates gut physiology and behavioral abnormalities associated with autism, Cell, 155(7): 1451-1463.
- Huttenlocher and Dabholkar, 1997 Regional Differences in Synaptogenesis in Human Cerebral Cortex, Journal of Camparative Neurology, 387:167–178 (1997).
- Jefferson 2004 Adverse events after immunisation with aluminium-containing DTP vaccines: systematic review of the evidence, The Lancet 4:84-90.
- Jones et al., 2016 Autism with Intellectual Disability is Associated with Increased Levels of Maternal Cytokines and Chemokines During Gestation, Molecular Psychiatry, 22(2):273-279.
- Khan et al., 2013 Slow CCL2-dependent translocation of biopersistent particles from muscle to brain, BMC Medicine, 11:99.
- Kindregan et al., 2015 Gait Deviations in Children with Autism Spectrum Disorders: A Review, Autism Research and Treatment, ID:741480.
- Knuesel et al., 2014, Maternal immune activation and abnormal brain development across CNS disorders, Nature Reviews 10:643-660.
Labouesse et al., 2015, Long-term pathological consequences of prenatal infection: beyond brain disorders, American Journal of Physiology, 309:1. - Li et al. 2009 Elevated Immune Response in the Brain of Autistic Patients, Journal of Neuroimmunology, 207(1-2): 111–116.
- Li et al., 2015 Neonatal vaccination with bacillus Calmette–Guérin and hepatitis B vaccines modulates hippocampal synaptic plasticity in rats, Journal of Neuroimmunology, 288
(2015) 1-12. - Machado et al., 2015 Maternal Immune Activation in Nonhuman Primates Alters Social Attention in Juvenile Offspring, Biological Psychiatry, 2015 May 1;77(9):823-32.
- Malkova et al., 2012 Maternal immune activation yields offspring displaying mouse versions of the three core symptoms of autism, Brain Behaviorand Immunity, 2012 May ; 26(4):
607–616. - Marques et al., 2014 Autism Spectrum Disorder Secondary to Enterovirus Encephalitis, Journal of Child Neurology, 2014, Vol. 29(5) 708-714.
- Mestas et al., 2004 Of Mice and Not Men: Differences between Mouse and Human Immunology, Journal of Immunology, 0022-1767:2731-2738.
- Meyer et al., 2006 The Time of Prenatal Immune Challenge Determines the Specificity of Inflammation-Mediated Brain and Behavioral Pathology, The Journal of Neuroscience,
26(18):4752– 4762. - Meyer et al., 2007 The neurodevelopmental impact of prenatal infections at different times of pregnancy: the earlier the worse?, Neuroscientist, Jun;13(3):241-56.
- Meyer et al., 2009 In-vivo rodent models for the experimental investigation of prenatal immune activation effects in neurodevelopmental brain disorders, Neuroscience and
Biobehavioral Reviews, 33 (2009) 1061–1079. - Meyer 2014, Prenatal Poly(I:C) Exposure and Other Developmental Immune Activation Models in Rodent Systems, Biological Psychiatry, 75:307-315.
- Mitkus et al., 2011 Updated aluminum pharmacokinetics following infant exposures through diet and vaccination, Vaccine 29 (2011) 9538–9543.
- Offit et al., 2003 Addressing Parents’ Concerns: Do Vaccines Contain Harmful Preservatives, Adjuvants, Additives, or Residuals? Pediatrics, 112(6): 1394-1401.
- Oskvig et al., 2012 Maternal immune activation by LPS selectively alters specific gene expression profiles of interneuron migration and oxidative stress in the fetus without triggering a fetal immune response, Brain Behavior and Immunity, 2012 May ; 26(4): 623–634.
- Pang et al., 2016 Exploiting macrophages as targeted carrier to guide nanoparticles into glioma, Oncotarget 7(24):37081.
- Parker-Athill and Tan, 2010 Maternal Immune Activation and Autism Spectrum Disorder: Interleukin-6 Signaling as a Key Mechanistic Pathway, NeuroSignals, 2010;18:113–128.
- Petrik et al., 2007 Aluminum Adjuvant Linked to Gulf War Illness Induces Motor Neuron Death in Mice, NeuroMolecular Medicine, Vol. 9, 83-100.
- Pineda et al., 2013 Maternal immune activation promotes hippocampal kindling epileptogenesis in mice, Annals of Neurology, 2013 July ; 74(1): 11–19.
- Podila et al., 2013 Toxicity of Engineered Nanomaterials: A Physicochemical Perspective, Journal of Biochemical and Molecular Toxicology, 2013 January ; 27(1): 50–55.
- Robertson et al., 2016 Reduced GABAergic Action in the Autistic Brain, Current Biology, 26, 1-6.
- Saad et al., 2016 Vitamin D status in autism spectrum disorders and the efficacy of vitamin D supplementation in autistic children, Nutritional Neuroscience, 19 (8) 346-351.
- Semple et al., 2013 Brain development in rodents and humans: Identifying benchmarks of maturation and vulnerability to injury across species, Progress in Neurobiology, Jul-Aug;106-
107:1-16. - Sethi et al., 2008 Aluminium-induced electrophysiological, biochemical and cognitive modifications in the hippocampus of aging rats, Neurotoxicology 29, 1069-1079.
- Sethi et al., 2009 Curcumin attenuates aluminium-induced functional neurotoxicity in rats, Pharmacology, Biochemisatry, and Behavior 93:31-39.
- Shen et al., 2016 Postnatal activation of TLR4 in astrocytes promotes excitatory synaptogenesis in hippocampal neurons, Journal of Cell Biology, 215(5):719-734.
- Sharifi et al., 2012 Toxicity of Nanomaterials, Chemical Society Reviews, 2012 Mar 21; 41(6): 2323–2343.
- Shaw and Petrik, 2009 Aluminum hydroxide injections lead to motor deficits and motor neuron degeneration, Journal of Inorganic Biochemistry 103 (11).
- Shaw and Tomljenovic, 2013 Administration of aluminium to neonatal mice in vaccine- relevant amounts is associated with adverse long term neurological outcomes, Journal of Inorganic Biochemistry, 128 (2013) 237–244.
- Shi et al., 2009 Activation of the Maternal Immune System Alters Cerebellar Development in the Offspring, Brain, Behavior, and Immunity, January, 23(1): 116–123.
- Smith et al., 2007 Maternal Immune Activation Alters Fetal Brain Development through Interleukin-6, Journal of Neuroscience, 2007 October 3; 27(40).
- Smith et al., 2012, Maternal Immune Activation Increases Neonatal Mouse Cortex Thickness and Cell Density, Journal of Neuroimmune Pharmacology, 7(3):529-532.
- Stiles et al., 2010 The Basics of Brain Development, Neuropsychology Reviews (2010) 20:327–348.
- Suzuki et al., 2011 Plasma Cytokine Profiles in Subjects with High-Functioning Autism Spectrum Disorders, PloS ONE 6(5).
Suzuki et al., 2013 Microglial Activation in Young Adults With Autism Spectrum Disorder, JAMA Psychiatry 70(1): 49-58.
————
- Takano 2015 Role of Microglia in Autism: Recent Advances, Developmental Neuroscience, 37:195-202.
- Tau and Peterson, 2010 Normal Development of Brain Circuits,
Neuropsychopharmacology, (2010) 35:147–168.
- Taylor et al., 2014 Vaccines are not associated with autism: An evidence-based meta- analysis of case-control and cohort studies, Vaccine, 32:3623-3629.
- Tomljenovic and Shaw, 2011 Do aluminum vaccine adjuvants contribute to the rising prevalence of autism? Journal of Inorganic Biochemistry 105.
- Tsilioni et al., 2015 Children with autism spectrum disorders, who improved with a luteolin-containing dietary formulation, show reduced serum levels of TNF and IL-6, Translational Psychiatry, 5, 647.
- Vargas et al., 2005 Neuroglial Activation and Neuroinflammation in the Brain of Patients with Autism, Annals of Neurology, 2005;57:67–81.
- Viezeliene et al., 2013 Selective induction of IL-6 by aluminum-induced oxidative stress can be prevented by selenium, Journal of Trace Elements in Medicine and Biology, 27:226-229.
- Wei et al., 2011 IL-6 is increased in the cerebellum of autistic brain and alters neural cell adhesion, migration and synaptic formation, Journal of Neuroinflammation 2011, 8:52.
- Wei et al., 2012 (a) Brain IL-6 elevation causes neuronal circuitry imbalances and mediates autism-like behaviors, Biochimica et Biophysica Acta, 1822 (2012) 831–842.
- Wei et al. 2012 (b) Alteration of brain volume in IL-6 overexpressing mice related to autism, International Journal of Developmental Neuroscience, 30:554-559.
- Wei et al., 2013 Brain IL-6 and autism, Neuroscience 252 (2013): 320–325.
- Wei et al., 2016 Inhibition of IL-6 trans-signaling in the brain increases sociability in the BTBR mouse model of autism, Biochimica et Biophysica Acta, 1862(10):1918-1925.
- Weir et al., 2015 Preliminary evidence of neuropathology in nonhuman primates prenatally exposed to maternal immune activation, Brain, Behavior, and Immunity, 48,139–146.
- Williams et al., 2006 The Profile of Memory Function in Children With Autism, Neuropsychology, 20(1): 21-29.
- Wobke et al., 2014 Vitamin D in inflammatory diseases, Frontiers in Physiology, 5: 244.
- Zerbo et al., 2014 Neonatal cytokines and chemokines and risk of Autism Spectrum Disorder: the Early Markers for Autism (EMA) study: a case-control study, Journal of Neuroinflammation, 11:113.
- Zerbo et al., 2017 Association Between Influenza Infection and Vaccination During Pregnancy and Risk of Autism Spectrum Disorder, JAMA Pediatrics, 171(1).
Extractado de : AUTISM & ALUMINUM ADJUVANTS IN VACCINES
How Aluminum Adjuvants in Vaccines Can Cause Autism https://drive.google.com/file/d/1viOi_HSvmVtJf67f5mvBgWnFOMIjFHEj/view?usp=sharing Informed Consent Action Network ICANDECIDE